Etats-Unis, Italie —Pendant plusieurs années, le développement du coeur artificiel de la société Carmat a connu des hauts et des bas, mais la start-up vient de franchir deux nouvelles étapes importantes.
Le 19 juillet, l’entreprise française a annoncé la première implantation commerciale de son cœur artificiel en Italie, alors que quelques jours auparavant, le dispositif avait été implanté pour la première fois chez l’homme aux Etats-Unis, dans le cadre d’une étude clinique.
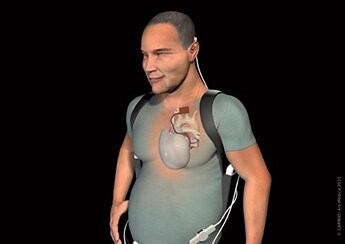
Le cœur artificiel total de CARMAT est composé d’une bioprothèse implantable et d’un système portable d’alimentation externe auquel elle est reliée en permanence. Il a été inventé par le Pr Alain Carpentier pour pallier le manque de greffons pour les personnes souffrant d’insuffisance cardiaque terminale irréversible. La première implantation chez l’homme a été réalisée en 2013 à l’hôpital européen Georges-Pompidou. En 2016, la start-up française a cependant dû stopper son essai clinique après la mort d’un cinquième patient. Aussi, en 2018, la société a suspendu son essai en Europe en raison des risques de dysfonctionnement des prothèses. Après des modifications, le cœur artificiel a obtenu le « marquage CE » pour l’indication d’attente de transplantation, fin décembre 2020. En parallèle, l’ANSM a autorisé Carmat à reprendre les implantations en France en octobre dernier. Une nouvelle étude clinique chez 52 patients greffés a débuté.
Depuis la première opération, seuls 20 patients ont reçu cette prothèse en France, au Kazakhstan, en République tchèque, au Danemark et tout dernièrement en Allemagne. Symbole de ce développement laborieux, le dispositif est commercialisé sous le nom de marque Aeson, en référence au héros de la mythologie grecque ramené à la vie, rajeuni par la sorcière Médée.
Une première implantation en Italie
La première implantation commerciale du cœur artificiel Aeson® a été pratiquée au centre hospitalier Azienda Ospedaliera dei Colli à Naples en Italie, soit 13 ans après sa conception.
« La chirurgie a été réalisée par le Dr Ciro Maiello et le Dr Cristiano Amarelli sans difficulté particulière grâce à l’excellente préparation et à la coopération entre notre service et les spécialistes de Carmat. Le patient se rétablit bien et, grâce à la combinaison des principales caractéristiques du dispositif – pulsatilité, hémocompatibilité et autorégulation – nous pensons qu’il bénéficiera d’une transition rapide vers une prise en charge ambulatoire », a commenté la Pr Marisa De Feo, directrice du département de chirurgie cardiaque générale et de transplantation à Azienda Ospedaliera dei Colli.
Suite à cette première vente, la société CARMAT anticipe qu’une douzaine de centres européens seront formés et actifs d’ici la fin de l’année 2021, essentiellement en France et surtout en Allemagne.
A ce stade, cinq hôpitaux allemands ont été formés par Carmat et sélectionnent actuellement des patients pour une implantation. Plusieurs dossiers de patients sont en cours d’analyse par ces hôpitaux. Une première implantation allemande a été rapportée par la firme le 26 juillet chez un patient souffrant d’une cardiopathie congénitale de longue durée qui a connu une décompensation fulgurante.
« Malheureusement, en raison de son état de santé critique et de son profil clinique extrêmement fragile, le patient est décédé au cours de la phase postopératoire. Nous avons néanmoins observé qu’Aeson® a pu stabiliser directement en peropératoire la situation hémodynamique du patient et a également pu faire face aux pressions artérielles pulmonaires élevées. Dans l’ensemble, nous avons été impressionnés par les performances prometteuses du dispositif et nous sommes impatients de l’inclure dans notre offre de soins pour sauver de nombreuses vies à l’avenir », a indiqué le Pr. Jan D. Schmitto, directeur du programme d’assistance circulatoire mécanique et de transplantation cardiaque à l’Ecole de médecine de Hanovre.
Une première étude clinique sur 10 patients aux Etats Unis
En parallèle de ces implantations italienne et allemande, une première intervention chez un homme de 39 ans a été réalisée dans le cadre d’un essai clinique de l’autre côté de l’Atlantique, au Duke University Hospital de Durham, l’un des quatre centres américains retenus par Carmat après le feu vert de la Food and Drug Administration (FDA) en septembre 2019.
Cette « première étude clinique américaine sera déterminante pour notre développement sur le plus grand marché mondial des dispositifs médicaux », a indiqué le directeur général de Carmat, Sté phane Piat, lors d’une conférence de presse virtuelle, qui s’est déroulée le 15 juillet. Dix patients éligibles à la transplantation devraient être recrutés pour cette première phase.
Le critère d’évaluation principal de l’étude américaine est la survie du patient 180 jours après l’implantation ou une transplantation cardiaque réussie dans les 180 jours suivant l’implantation.
Il s’agit d’une étude par étapes avec un rapport sur l’état d’évolution des trois premiers patients après 60 jours, avant le recrutement des sept patients suivants.
La commercialisation du dispositif n’est pas attendue avant 2024 aux Etats-Unis.
Quelles perspectives ?
En Europe, le marché potentiel s’élève à 2 000 patients par an selon les estimations de Carmat qui s’appuient sur les listes d’attente pour une transplantation cardiaque dans les cinq principaux pays européens (France, Allemagne, Italie, Espagne et le Royaume-Uni).
Et concernant le marché aux Etats-Unis, l’équipe du Duke University Hospital aux Etats-Unis s’est livrée à un rapide calcul. Sachant que le nombre de nouveaux cas d’insuffisance cardiaque aux Etats-Unis est d’environ 100 000 par an, et que seuls 3 000 à 4 000 de ces patients peuvent bénéficier d’une transplantation cardiaque, une grande part des 96 000 patients restants pourrait potentiellement bénéficier du dispositif.
« Les retours que nous recevons, tant dans le cadre de nos études cliniques, notamment tout récemment aux Etats-Unis, que de nos échanges avec les centres européens dans le cadre de la commercialisation d’Aeson®, nous rendent très confiants dans le fait que notre cœur artificiel « change la donne » et apporte un bénéfice-patient unique par rapport à toutes les thérapies existantes », a souligné le directeur général de Carmat.


